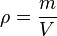A balloon full of air (view A) does nothing unless the trapped air is released. When the air is released, it escapes rearward, causing the balloon to move forward (Newton’s third law) (view B).
If you could devise a way to keep the balloon constantly full of air, it would continue to move forward (view C) as long as the air is allowed to escape from it. If you place a fan or pinwheel in the
escaping airstream, the pressure energy and velocity energy will cause the fan to rotate. Then you can use the escaping air to do work (view D).
Now, if you replace the balloon with a firmly mounted tube or container and keep it filled with air from a fan located in the air opening and driven by an external source, you could use the discharge air to turn a fan at the rear to do work (view E).
If you add fuel and allow combustion to occur (view F), the volume of air and the velocity with which it passes over the exhaust fan are greatly increased (Charles’s law). The horsepower the fan will produce is also increased. The continuous pressure created by the inlet fan, or compressor, prevents the hot gases from going forward.
Now, if you attach a shaft to the compressor and extend it back to a turbine wheel, you have a simple GTE (view G). It can supply power to run its own compressor and still provide enough power to do useful work.
1. Air is taken in through the air inlet duct by the compressor. There it is raised in pressure and discharged into the combustion chamber (or combustor).
2. Fuel is admitted into the combustion chamber by the fuel nozzle(s). The fuel-air mixture is ignited by an igniter(s) (not shown) and combustion occurs.
3. The hot and rapidly expanding gases are directed aft through the turbine rotor assembly. There, thermal and kinetic energy are converted into mechanical energy. The gases are then directed out through the exhaust duct.
Un globo lleno de aire (A) no hace nada si el aire queda atrapado. Cuando se suelta el aire, este escapa hacia atrás provocando que el globo se mueva hacia adelante (3ª Ley de Newton principio de Acción y Reacción).
Si pudiésemos mantener el globo, continuamente lleno de aire, el globo continuaría moviéndose (C) hasta que escape todo el aire en el contenido. Si ponemos un ventilador o rueda en el flujo de aire del escape, la energía de la presión y la velocidad provocaran que el ventilador gire. Entonces podremos usar el aire del escape para producir trabajo (D).
Ahora, si reemplazamos el globo con un tubo o recipiente, en un montaje fijo, y lo mantenemos lleno de aire del ventilador situado en la salida de aire y conducido por una fuente externa, se puede utilizar el aire de descarga para encender un ventilador en la parte trasera para hacer trabajo (ver E).
Si añades fuel y permites una combustión (F), el volumen del aire y su velocidad cuando pase por el escape a través del ventiladores está muy incrementado (ley de Charles). La potencias en caballos de vapor desarrollada por el ventilador también será aumentada. La continua presión creada por el ventilador de entrada, o el compresor, evita la entrada de gases calientes.
Ahora bien, si conectamos un eje al compresor y lo extendemos hasta la rueda de la turbina, que tiene una turbina de gas simple (G), podemos suministrar energía para hacer funcionar su propio compresor y seguir proporcionando energía suficiente para hacer un trabajo útil.
- El aire es cogido e introducido en el conducto del compresor, donde se eleva la presión y se descarga en la cámara de combustión.
- El fuel es admitido en la cámara de combustión a través de los inyectores. La mezcla de aire-combustible es encendida por la bujía y se produce la combustión
- La rápida expansión de los gases calientes son direccionados hacia a tras a través del ensamblaje rotor – turbina. Es entonces cuando se transforma la energía térmica y cinética en energía mecánica. Los gases ahora son conducidos al conducto del escape.